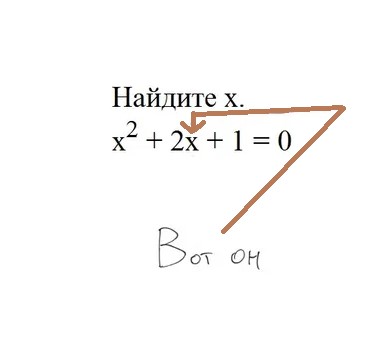ЕГЭ 2025
Если тебе нужно сдать ЕГЭ или ОГЭ, то образовательный портал 8 Бит – это лучшее, что ты мог найти. На этом портале ты не только найдешь ответы на самые важные вопросы, связанные с ЕГЭ, но и найдешь всю теорию по всем предметам школьной программы.